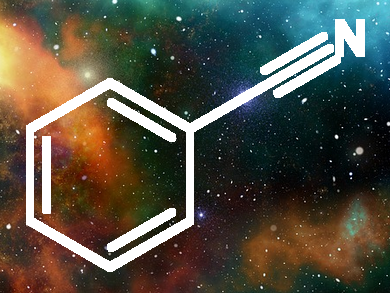
Il benzonitrile è il composto organico con formula C6H5CN, abbreviato come PhCN. È un composto aromatico liquido, incolore, con un odore di mandorla amara. Viene usato principalmente nella sintesi di benzoguanammina, un precursore per polimeri termoindurenti.
Storia
Il benzonitrile fu descritto nel 1844 da Hermann von Fehling, che lo trovò nei prodotti di decomposizione termica del benzoato di ammonio. Fehling ne dedusse la struttura in base all'analoga reazione del formiato di ammonio che produce acido cianidrico. Fehling coniò anche il nome benzonitrile che fu poi esteso a tutto il gruppo dei nitrili.
Sintesi
Il benzonitrile si produce industrialmente per ossidazione ad alta temperatura del toluene in presenza di ammoniaca:
In laboratorio si può preparare per disidratazione della benzammide o tramite la reazione di Rosenmund-von Braun da cianuro di rame(I) e bromobenzene:
Reattività
Il benzonitrile è un composto stabile, ma in presenza di acidi o basi viene idrolizzato formando acido benzoico e ammoniaca. È miscibile con i normali solventi organici, ed è un ottimo solvente per alcuni polimeri come ad esempio polivinilcloruro, polistirene e polimetilacrilato. Idrogenando il benzonitrile si ottiene benzilammina.
Applicazioni
In campo industriale il benzonitrile è usato principalmente nella sintesi di benzoguanammina, un precursore per polimeri termoindurenti.
In laboratorio è usato come solvente o come precursore per ottenere altri derivati organici. Il benzonitrile può legarsi a metalli di transizione formando complessi labili e solubili in solventi organici. Un esempio è PdCl2(PhCN)2. Questi complessi sono utili per sintesi successive, dato che il legante benzonitrile viene facilmente rimpiazzato da altri leganti.
Tossicità / Indicazioni di sicurezza
Il benzonitrile è disponibile in commercio. Il composto è nocivo per ingestione e per contatto col la pelle. Non ci sono evidenze di effetti cancerogeni. In caso di combustione può sviluppare cianuro di idrogeno e ossidi di azoto. Risulta nocivo per gli organismi acquatici, ma è rapidamente biodegradabile.
Note
Bibliografia
- G. K. Anderson e M. Lin, Bis(Benzonitrile)Dichloro Complexes of Palladium and Platinum, in Inorg. Synth., vol. 28, 1990, pp. 60-63, DOI:10.1002/9780470132593.ch13. URL consultato il 9 marzo 2014.
- F. C. Cooper e M. W. Partridge, N-Phenylbenzamidine, in Org. Synth., vol. 36, 1956, p. 64. URL consultato il 9 marzo 2014.
- H. Fehling, Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme, in Justus Liebigs Ann. Chem., vol. 49, n. 1, 1844, pp. 91-97, DOI:10.1002/jlac.18440490106. URL consultato il 9 marzo 2014.
- GESTIS, Zinc sulfide, su Pagina del solfuro di zinco nel data base GESTIS. URL consultato il 4 marzo 2014 (archiviato dall'url originale il 9 marzo 2014).
- (EN) T. Maki, Benzoic Acid and Derivatives, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a03_555.
- (EN) P. Patnaik, A comprehensive guide to the hazardous properties of chemical substances, 3ª ed., Wiley-Interscience, 2007, p. 480, ISBN 0-471-71458-5.
- P. L. Pickard e T. L. Tolbert, Diphenyl ketimine, in Org. Synth., vol. 44, 1964, p. 51. URL consultato il 9 marzo 2014.
- Sigma-Aldrich, Scheda di dati di sicurezza del benzonitrile.
Altri progetti
- Wikimedia Commons contiene immagini o altri file su Benzonitrile